

Voici un nouvel article qui va, j’en suis sur, égayer vos futures fêtes de fin d’année puisque nous allons parler du champagne, et plus précisément de la façon dont se forme les bulles.
De quelles bulles s’agit-il ?
Vous vous en doutez, pas de gaz dans le raisin ! les bulles que l’on trouve alors dans le champagne, comme dans toutes les boissons gazeuses d’ailleurs, sont des bulles de gaz carbonique.
La question qui vient est comment ce gaz carbonique arrive-t-il dans la bouteille ?
Il est le résultat d’une méthode de vinification que l’on réalise dans la méthode “champenoise” qu’on appelle : Seconde fermentation.
Après la première étape de fermentation au moment où on va mettre le vin en bouteille, on rajoute un liquide au vin, de la liqueur de tirage, qui contient entre autre du sucre et des levures. On parle aussi de “prise de mousse”.
Ci-dessous vous avez l’équation chimique de la transformation de sucre en alcool par l’action des levures et du dégagement de gaz carbonique:
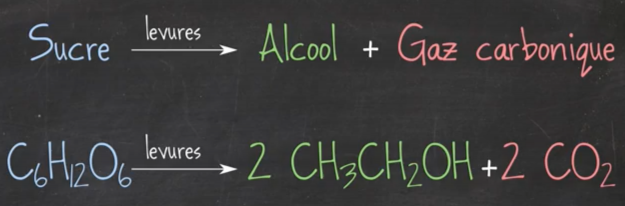
Cette réaction chimique est lente et se réalise dans la bouteille fermée. Le gaz s’accumule donc avec le temps dans le récipient et se dissout au coeur du breuvage.
Bizarrement, lorsque vous regardez une bouteille de champagne avant de l’ouvrir, vous n’observerez pas de bulles… Que sont elles devenues ?
Une partie du gaz se situe directement sous le bouchon sous sa forme gazeuse et le reste se trouve en solution dans le vin sous forme diluée.
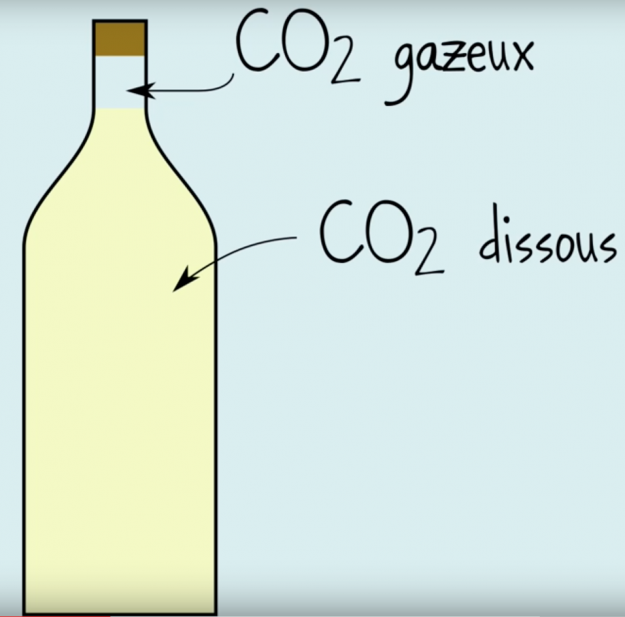
C’est bien sur le gaz situé sous le bouchon qui crée la pression à l’intérieur de la bouteille et qui fait sauter le bouchon au moment où on l’ouvre. On peut y trouver une pression d’environ 6 bars soit 6 Kgs par cm2 ! Attention de ne pas diriger votre bouchon vers la tête de quelqu’un lorsque vous ouvrez une bouteille, cela reste dangereux !
Au sein du liquide il faut simplement imaginer des molécules de gaz carboniques qui se promènent librement dans le liquide séparées les unes des autres.
Entre le gaz dissous et le gaz en pression, il existe une condition d’équilibre qui peut s’écrire sous la forme d’une équation (et oui encore) et que l’on appelle la loi de Henry et que les amateurs de plongée sous marine connaissent parfaitement. Cette loi relie en effet la concentration d’un gaz en solution avec la pression de ce même gaz à l’air libre selon la formule :
P = H . C, avec P la pression au dessous du bouchon en bars, C la concentration de gaz dans le liquide en g/l et H la constante de proportionnalité qui s’exprime en (bars/(g/l)) et qui, pour le champagne à température de service, vaut environ 0,5 bars/(g/L)).
Maintenant imaginez-vous ce qu’il se passe quand on ouvre la bouteille : La pression en surface du liquide diminue brutalement puisque le gaz s’échappe, et l’équilibre est rompu : Comme la pression du CO2 gazeux a diminué, la concentration de CO2 dissous doit diminuer d’autant.
Autrement dit le CO2 veut s’échapper du liquide : c’est ce qui provoque l’effervescence !
Comment se forme les bulles dans le champagne ?
Nous avons compris que l’ouverture d’une bouteille de champagne doit nécessairement s’accompagner d’un dégagement du CO2 dissous. Mais ce dégagement n’est pas instantané ! Des bulles de gaz carbonique se forment dans le liquide et s’échappent.
La naissance d’une bulle s’appelle la nucléation, et nous allons voir que cette naissance ne peut pas avoir lieu n’importe comment, ni n’importe où.
En théorie, à partir du moment où l’équilibre a été rompu, les bulles peuvent se former de manière spontanée n’importe où dans le liquide : c’est ce qu’on appelle la nucléation homogène. Cependant en pratique, cela ne se produit jamais ! Dans sa thèse sur le sujet, un chercheur (Cédric Voisin) a calculé le taux de nucléation homogène, et il est si faible que même dans un océan de champagne, cela ne se produirait jamais même en plusieurs millions d’années !
L’autre mécanisme possible est ce qu’on appelle la nucléation hétérogène : l’idée est que la bulle ne se forme pas spontanément à partir de rien, mais utilise une petite poche de gaz préexistante pour faciliter sa naissance. Une preuve indirecte que ce mécanisme est à l’œuvre, c’est que dans un verre de champagne on observe clairement que les bulles montent en colonnes, comme si elles naissaient dans des endroits bien particuliers.

On a pensé un moment que de petits défauts du verre (comme des anfractuosités) pouvaient être à l’origine de la nucléation hétérogène des bulles. Mais en pratique il faudrait des aspérités vraiment grosses – presque 1 millimètre calcule Cédric Voisin, chercheur, pour que le mécanisme fonctionne. Il ne peut donc pas expliquer ce qui se passe dans nos verres traditionnels, qui sont suffisamment lisses. On peut néanmoins observer ce type de nucléation si on grave l’intérieur du verre avec par exemple une pointe en diamant, comme sur la vidéo ci-dessous.
Si les anfractuosités du verre ne sont pas responsables de la nucléation des bulles, quoi donc ? Le coupable a finalement été identifié par le chercheur Gérard Liger-Belair : ce sont des fibres de cellulose ! A l’aide d’une caméra rapide et d’une lentille grossissante, il a été observé que dans la quasi-totalité des cas, il y a une minuscule fibre à la base d’une colonne de bulle. Ces fibres proviennent de l’atmosphère, de nos vêtements, des chiffons utilisés pour essuyer les verres, et fonctionnent comme de véritable usines à produire des bulles, comme l’illustre l’image ci-dessous.
En voici le mécanisme : ces fibres sont initialement creuses, et emprisonnent donc une petite poche d’air. Lorsque le champagne entoure la fibre, le gaz carbonique est attiré par la poche d’air et y pénètre en la faisant grossir.
Quand la poche chargée de CO2 atteint une certaine taille critique, une bulle se détache et monte dans le verre. La beauté de la chose, c’est que ce détachement de la bulle laisse systématiquement un petit reste derrière lui, qui sert de poche pour initier la bulle suivante.
Ce mécanisme, illustré ci-dessous, permet bien de comprendre pourquoi les bulles sont produites en groupe, et avec une fréquence relativement régulière sur un même site de nucléation.
On entend souvent que la finesse des bulles est indicative de la qualité d’un champagne. Cette idée n’est pas absurde a priori, puisqu’il est reconnu que les bulles ont un rôle essentiel dans les qualités gustatives de la boisson. Lorsqu’elles montent dans le verre, elles se chargent en molécules aromatiques qui sont libérées lors de l’explosion de la bulle en surface. Les bulles agissent donc comme un exhausteur de goût, et sans elles le champagne ne serait pas si savoureux !
Mais pour autant, est-ce vrai que la finesse des bulles indique un bon champagne ? Eh bien non !
G. Liger-Belair a montré que la taille des bulles dépend essentiellement de deux facteurs : la quantité de CO2 dissoute et la hauteur du verre. Moins il y a de CO2, plus les bulles seront fines, mais plus le verre est haut, plus elles grossiront avant d’atteindre la surface. Donc rien à voir avec la qualité de la boisson !
Joyeuses fêtes à tous ! Pour ma part, je vous retrouve en 2017 !

Quelques précisions sur les mécanismes de libération du gaz carbonique : tout d’abord, je n’ai pas dit que ce qui compte dans la loi de Henry, c’est la pression partielle du gaz, et pas la pression totale.
Quand on ouvre une bouteille de champagne, la pression partielle de CO2 passe donc de quelques bars à essentiellement zéro, car il y a très peu de CO2 dans l’atmosphère. Par ailleurs j’ai appris en lisant la thèse de Cédric Voisin que le bullage n’est pas le mécanisme dominant ! Seul 15 à 30% du gaz s’échappe sous forme de bulles, le reste étant directement échangé au niveau de la surface. Enfin le coefficient de la loi de Henry dépend notamment de la température. Il est environ deux fois plus faible à température de service qu’à température ambiante, ce qui explique qu’une variation brutale de température puisse accélérer l’effervescence.
Un point pas si clair pour moi concerne la manière dont la petite poche de gaz située dans une fibre « sait » que la pression partielle de CO2 en surface a diminué. J’ai l’impression que cela ne joue pas de rôle et que ce qui compte c’est la pression totale, car c’est elle qui va fixer la pression hydrostatique sur la poche de gaz (qui après quelques cycles est composée essentiellement de CO2). Si ce que je dis est vrai, si on place notre verre de champagne dans une atmosphère d’azote à pression de 6 bars, le bullage va s’arrêter (mais pas le dégazage direct en surface, qui lui dépend de la pression partielle de CO2 en surface).
Sur le rôle des fibres : j’ai entendu parler de vidéos où l’on voit le champagne dans un verre parfaitement propre, et qui ne pétille pas ! Je crois même qu’une a été tournée dans mon ancien labo…mais je n’ai rien trouvé sur le net. Si quelqu’un a quelque chose à proposer…
Remerciements à David Louapre pour son aide précieuse .